 Das Anleitungsbuch zum KOSMOS-Baukasten Chemie geht auch auf Holzkohle und Holzasche ein.
Das Anleitungsbuch zum KOSMOS-Baukasten Chemie geht auch auf Holzkohle und Holzasche ein.
18. Untersuchung des Holzes
Wir haben unsere bisherigen Versuche zumeist an Salzen, Gesteinen und zuletzt an Farbkörpern vorgenommen, also an Stoffen, die der unbelebten Natur entstammen.
Man glaubte früher, daß die Gesetze der Chemie nur für diese unbelebten Stoffe gelten und unterschied eine besondere Chemie der Lebewesen als organische Chemie von der unorganischen Chemie. Erst seit Friedrich Wöhler in Jahre 1828 den sonst nur im lebenden Tierkörper entstehenden Harnstoff aus Kalk, Kohlenstoff usw. also aus rein mineralischen Stoffen, herzustellen vermochte, ist erwiesen, daß auch die Stoffe des Pflanzen- und Tierreichs aus denselben Elementen aufgebaut sind und ähnlichen Gesetzmäßigkeiten unterliegen.
Wir können es daher wagen, unsere Untersuchungen auf Stoffe aus dem Pflanzen-und Tierreich auszudehnen.
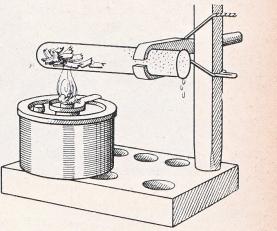 1. Als erstes untersuchen wir ein Stück recht trockenes Holz, etwa einen Splitter, den wir von einer alten Kiste abgesprengt haben. Durch die lange Lagerung wird dieses Holz sicher ganz ausgetrocknet sein. Wir legen ein 5 cm langes Stück in ein waagrecht befestigtes Probierglas und erhüben es mit der Spiritusflamme. Das Probierglas beschlägt sich innen mit Wasser, das somit noch in dem trockensten Holz enthalten sein muß. Bei weiterem Erhitzen wird die Flüssigkeit durch allmähliches Zersetzen des Holzes bräunlich, und es verbreitet sich ein brenzliger Geruch. Der Holzsplitter wird nach und nach schwarz.
1. Als erstes untersuchen wir ein Stück recht trockenes Holz, etwa einen Splitter, den wir von einer alten Kiste abgesprengt haben. Durch die lange Lagerung wird dieses Holz sicher ganz ausgetrocknet sein. Wir legen ein 5 cm langes Stück in ein waagrecht befestigtes Probierglas und erhüben es mit der Spiritusflamme. Das Probierglas beschlägt sich innen mit Wasser, das somit noch in dem trockensten Holz enthalten sein muß. Bei weiterem Erhitzen wird die Flüssigkeit durch allmähliches Zersetzen des Holzes bräunlich, und es verbreitet sich ein brenzliger Geruch. Der Holzsplitter wird nach und nach schwarz.
Wenn die Entwicklung von Dämpfen aufgehört hat, lassen wir das Holzstück herausgleiten.
2. Es ist schwarz. Unsere Vermutung geht auf Kohlenstoff, denn dieser ist schwarz und brennt mit Glut. Wir halten das schwarz gewordene Holzstück mit den Enden in die Flamme, es beginnt zu glühen und glüht außerhalb der Flamme noch längere Zeit
weiter. Holz enthält tatsächlich Kohlenstoff.
3. Unser Holzstück ist also durch Austreiben des Wassers zu Holzkohle geworden. Man bezeichnet den Vorgang unseres Versuches als trockene Destillation.

Weil Holzkohle ein reinerer Brennstoff ist als z. B. Holz, hat man sie früher zur Heizung der Bügeleisen verwendet, auch für Schmiedefeuer und sogar zur Beschickung der Hochöfen. Um den gewaltigen Bedarf an Holzkohle zu decken, wurde die Verkohlung in den Wäldern, in sogenannten Kohlenmeilern, vorgenommen.
Die im vorhergehenden Versuch dem abdestillierten Wasser beigemengten, teil-
weise durch Zersetzung entstandenen Stoffe werden wir später untersuchen.
4. Durch unseren Versuch sind in dem Holz Kohlenstoff und Wasser nachgewiesen. Weil Wasser die Elemente Wasserstoff und Sauerstoff enthält, wissen wir, daß Holz in der Hauptsache aus den Elementen Kohlenstoff, Wasserstoff und Sauerstoff zusammengesetzt ist. Wasserstoff und Sauerstoff sind ausgetrieben worden, während der Kohlenstoff zurückblieb.
5. Wir können den zurückgebliebenen Kohlenstoff vernichten, indem wir ihn verbrennen. Dazu erhitzen wir ein Ende unserer selbstgemachten Holzkohle in der Flamme zum Glühen und lassen die Glut, ohne sie durch Blasen anzufachen, außerhalb der Flamme allmählich erlöschen. Wir betrachten die geglühte Stelle und bemerken einen weißen Anflug von Asche. Diese enthält in geringer Menge noch einige Bestandteile des Holzes, die wir vor der Vernichtung des Kohlenstoffes nicht sehen konnten. Diese Bestandteile haben der Verbrennung widerstanden. Es sind nämlich Mineralien, Gesteinsteile, die die Pflanze durch die Wurzeln aus dem Boden aufgenommen hat. Unser Ziel ist jetzt, festzustellen, welche Mineralstoffe in der Pflanzenasche enthalten sind.
6. Statt der geringfügigen Aschenmenge des vorhergehenden Versuchs beschaffen wir uns aus einem Ofen ein Trinkglas voll Holzasche, oder wir sammeln nach und nach ebensoviel Zigarrenasche. Holzasche muß vor der Verwendung gesiebt werden. Die Abbildung erläutert, wie unser Drahtnetz zusammen mit dem Wassergefäß eine gute Anordnung dazu abgibt. Wir verwenden nur die feine Asche, die durch das Sieb gegangen ist. Den Rest mit den noch unverbrannten Holzteilchen usw. schütten wir weg.
7. Wir füllen die Kochflasche zu zwei Drittel mit Wasser, das wir auf dem Drahtnetz über der Flamme erwärmen, und streuen nun die Holzasche hinein, nachdem die Flamme weggenommen wurde. Wenn man die Flasche zusammen mit der Asche erhitzt, springt sie. Die Masse soll mit dem Glasstab umgerührt werden.
Das heiße Wasser löst alle Aschenbestandteile, soweit sie löslich sind.
8. Die Aschenlösung gießen wir nun auf einen Filter und fangen die durchfließende Flüssigkeit in der Porzellanschale und in einigen Probiergläsern auf. Auf dem Filter bleiben die unlöslichen Aschenteile. Um die löslichen Bestandteile zu gewinnen, verdampft man das Wasser und gibt nach und nach auch die in den Probiergläsern aufgehobenen Teile des Filtrats hinzu. Wenn die Lösung zu stoßen beginnt, und schon deutliche Mengen Salz sich am Grunde der Schale abgelagert haben, deckt man mit einem Uhrglas zu und verdampft den Rest bis zum Trocknen.
9. Weil das Eindampfen der großen Flüssigkeitsmengen einige Zeit dauert, beschäftigen wir uns inzwischen mit dem auf dem Filter gebliebenen unlöslichen Teil der Aschensalze. Wir falten den Filter auseinander und bringen die dunkle Aschenmasse so gut es geht in die Kochflasche.
10. Was geschieht, wenn man auf den Rückstand einen Tropfen Salzsäure fallen läßt? Das Aufbrausen zeigt ein Karbonat an, das unlöslich sein muß, sonst wäre es durch den Filter geflossen.
Als lösliches Karbonat ist uns die Soda bekannt. Vom Kalkstein wissen wir, daß er ein unlösbares Karbonat darstellt. Wir vermuten daher, daß in der Aschenmasse unlöslicher Kalkstein enthalten ist. Diesen verwandelt man in lösliches Kalziumchlorid, indem die Masse so lange mit Salzsäure übergossen wird als noch ein Brausen erfolgt. Wir wollen auch darauf achten, welcher Geruch gleich zu Beginn der Salzsäurezugabe auftritt. Später könnte er nicht mehr wahrgenommen werden.
Wenn ein Geruch nach Schwefelwasserstoff auftritt, wissen wir, daß Sulfide zugegen sein müssen. Dies ist nur möglich, wenn in der Pflanze das Element Schwefel enthalten war. Schwefel wäre somit als weiterer Bestandteil der Pflanze nachgewiesen.
11. Wenn im vorhergehenden Versuch das Brausen aufgehört hat, ist alles Karbonat in Chlorid verwandelt.
Um nun den als Chlorid in Lösung gegangenen Kalk von den übrigen unlöslichen Teilen zu trennen, wird filtriert. Jet^t ist das Kalziumchlorid mit anderen Chloriden im Filtrat enthalten. Der Rückstand auf dem Filter ist auch merklich geringer geworden, weil eben der Kalk davon weggelöst wurde. Es scheint, daß ein ziemlich großer Teil der Asche aus unlöslichem Kalkstein bestand.
12. Es bleibt noch zu beweisen, daß das umgewandelte Karbonat auch wirklich Kalziumkarbonat war.
In Versuch 10/12 hatten wir durch Eingießen von Schwefelsäure in die Kalziumchloridlösung einen Niederschlag von Gips erhalten. Wenn dies wieder eintritt, ist das Vorhandensein von Kalk sicher nachgewiesen. Man gieße etwas Schwefelsäure in die Lösung.
13. Gips ist fast unlöslich, läßt sich also durch Filtrieren von der Flüssigkeit trennen. Nachdem dies geschehen, sind wir sicher, daß keinerlei Kalziumverbindungen mehr im Filtrat enthalten sein können, aber es läßt sich denken, daß noch andere, vorher unlöslich gewesene Stoffe als Chloride in das Filtrat übergegangen sind, z. B. Eisenverbindungen als Eisenchlorid, Magnesiumverbindungen als Magnesiumchlorid usw., auch wenn durch die Behandlung mit Schwefelsäure daraus jetzt Eisensulfat und Magnesiumsulfat geworden sind, befinden sie sich jetzt im neuen Filtrat.
Zu einem Teil gebe man etwas aufgelöstes gelbes Blutlaugensalz (Röhrchen 102), dem zweckmäßig einige Tropfen Salpetersäure beigefügt werden. Blutlaugensalzlösung gibt mit Eisensalzen Blaufärbung. Wenn wir dies beobachten können, ist bewiesen, daß in der Pflanzenasche Eisen enthalten ist.
(14.) Spinat gilt als besonders eisenreich. In der Asche von Spinatblättern, die durch Salzsäure aufgelöst wurde, kann nach Filtrieren der Nachweis in obiger Weise geleistet werden.
(15.) Auch Blut enthält Eisen. Zum Nachweis erhitzt man in der Porzellanschale 3 ccm Tierblut, bis es unter Ausstoßung übelriechender Dämpfe verkohlt. Dann gibt man nach Abkühlen der Porzellanschale zum Auflösen des Eisens Salzsäure hinzu und filtriert. Im Filtrat gibt Blutlaugensalzlösung wie oben Blaufärbung.
16. Inzwischen sind die löslichen Aschensalze zu Ende eingedampft. Wir haben in der Schale ein schmutzig aussehendes Salz. Das Salz ist bekannt unter dem Namen Pottasche. Es wurde früher von den Bäuerinnen durch Eindampfen von Aschenlösung in Töpfen bereitet (Pott = Topf) und zum Waschen verwendet. Durch Glühen der Pottasche auf dem Deckel einer Blechdose wird das Salz schön weiß.
17. Was ist Pottasche? Wir nehmen die Hälfte der Salzkruste auf ein Papierblatt heraus und übergießen eine kleine Probe davon in einem Probierglas mit Salzsäure. Das Aufbrausen beweist, daß Pottasche ein Karbonat ist.
18. Die Flammenfärbung sollte noch zeigen, welches Metall in dem Salz steckt. Weil möglicherweise noch andere Salze in der Masse enthalten sind, ist die gelbe Flamme auch noch durch das blaue Glas zu betrachten. Wenn die blaue Flammenfärbung bestehen bleibt, ist Kalium nachgewiesen. Siehe Versuch 5/40. Neben geringer Menge Natriumsalz ist die Masse in der Hauptsache Kaliumkarbonat = K2C03.
19. Wir erinnern uns, daß Soda, Na2C03, beim Herumliegen an der Luft zu einem trockenen Pulver zerfiel. Wir lassen ein Viertel der eben hergestellten Pottasche auf einem Uhrglas einen Tag an der Luft liegen. Sie scheint sich gerade entgegengesetzt zu verhalten wie die Soda, eher in der Art wie das Kalziumchlorid in Versuch 10/9. Pottasche ist wassergierig oder hygroskopisch.
20. Wir können das wassergierige Aschensalz auf einem Uhrglas mit Wasser übergießen und so wieder auflösen. Die eine Hälfte der Lösung wird für Versuch 21 zurückgestellt. In die andere lassen wir einen Tropfen Silbernitratlösung (Glas 59) fallen. Der weiße Niederschlag ist seit Versuch 16/1 das Erkennungszeichen eines Chlorids. Die Asche enthält auch ein Chlorid, nämlich Natriumchlorid = Kochsalz, also das Element CI.
21.In Versuch 8/6 haben wir uns eine Ammoniummolybdatlösung (Röhrchen 106) mit Zusatz von Salpetersäure bereitet. Wir haben sie zum Nachweis der Phosphorsäure benutzt. Wenn man sie mit einem phosphorhaltigen Stoff zusammen erwärmt, entsteht eine gelbe Trübung.
Wir geben zum zweiten Teil der Aschenlösung aus Versuch 20 eine gleiche Menge Ammoniummolybdat-Salpetersäurelösung und erwärmen. Die eintretende Gelbfärbung beweist, daß in der Asche Phosphorsäure, also das Element Phosphor enthalten ist.
22. Nach Anweisung des Versuches 16/29 könnte in der Asche noch Magnesium nachgewiesen werden, das ebenfalls in der Pflanze enthalten ist.
23. Es bleibt noch ein Stoff in den Pflanzen nachzuweisen, der uns bisher entgangen ist. Hierzu mischen wir etwas Sägemehl mit ebensoviel pulverigem, gebranntem Kalk (Glas 58), geben diese Mischung in ein Probierglas, setzen Stopfen mit Ableitungsrohr darauf und erhitzen. Es entweicht ein Gas; dem Geruch nach ist es Ammoniak NH3. Der wie eine Lauge wirkende gebrannte Kalk treibt aus dem Holz NH3 aus. Der Stickstoff N stammt aus dem Sägemehl. Er ist ein ständiger Bestandteil der Pflanzen, namentlich der sogenannten Eiweißstoffe.
Weise mit einem in Salzsäure getauchten Stab nachgewiesen werden. Ferner wissen wir, daß Ammoniakgas rotes Lackmuspapier blau färbt. Man halte solches an die Mündung der Röhre. Es färbt sich blau.
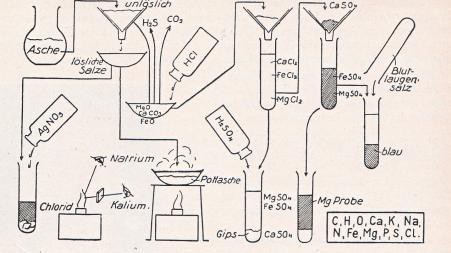
24. Die Abbildung stellt den Gang unserer Aschenuntersuchung dar, die als Bestandteile die rechts unten verzeichneten Elemente ergab. Man vergegenwärtige sich an Hand der Zeichnung nochmals den Arbeitsgang. Alle diese Elemente könnten nicht nur in der Holzasche, sondern in jeder beliebigen Pflanzenasche als nie fehlende Bestandteile nachgewiesen werden.
Wir fassen zusammen:
Alle Pflanzen bestehen zu 50 — 70 % aus Wasser, die Hälfte der Trockensubstanz, also 15 — 20%, ist Kohlenstoff.
A
Die P f 1 a n z e n a s c h e enthält die u n v e r b r e n n b a r e n mineralischen Bestandteile der Pflanzen, die sie durch die Wurzeln aufgenommenhaben.
B
Alle Pflanzen enthalten die Elemente C, H, O, Ca, K, Na, N, Fe, Mg, P, S und Cl als nie fehlende Bestandteile.
Antworten